L'ostéoporose en questions-réponses
- Détails
- Mis à jour le 19 juin 2012
étymologiquement l’ostéoporose veut dire: os poreux. C’est une affection diffuse du squelette caractérisée par une diminution de la masse osseuse et des perturbations microarchitecturales du tissu osseux entraînant une augmentation de la fragilité osseuse et du risque de fractures. Elle a été définie comme telle au cours d’une conférence de consensus tenue à Hong Kong en 1993. Il ressort de cette définition qu’il existe deux composantes à la fragilité osseuse: la quantité et la qualité :
- La microarchitecture osseuse dépend de la qualité du collagène et des cristaux et de la capacité de réparation des microfractures. Elle n’est pas accessible à la mesure par une technique non invasive. Son étude nécessite donc une biopsie osseuse.
- La masse osseuse peut être évaluée par plusieurs techniques de mesure qui se sont développées ces dernières années en permettant une estimation précise fiable et reproductible.
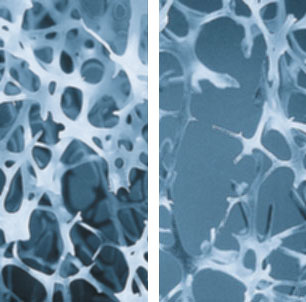
Les études épidémiologiques ont confirmé que le risque de fracture était étroitement corrélé à la densité minérale osseuse (DMO). Les résultats peuvent être exprimés en valeur absolue en g/cm2 ; mais le plus souvent la mesure obtenue est comparée à des valeurs de référence issues d’une population normale. Deux modes de présentation des résultats sont utilisés : le Z score qui indique l’écart entre la valeur du patient et la valeur moyenne de sujets normaux de même âge et de même sexe ; et le T score qui traduit l’écart entre la valeur du patient et la valeur moyenne des adultes jeunes du même sexe exprimé ici encore en nombre d’écart-type. C’est ce dernier indice indépendant de l’âge qui a été choisi par les experts de l’Organisation Mondiale de la Santé (OMS) pour définir chez la femme ménopausée la normalité l’ostéopénie et l’ostéoporose. L’IOF (International Foundation of Osteoporosis) a modifié ces critères en décidant de prendre la mesure au col fémoral comme le site de mesure de référence.
Définition de l’ostéoporose selon l’Organisation Mondiale de la Santé (critères modifiés par l’IOF):
| T-score > -1 (hanche) | normal |
|
T-score < -1 et >-25 (hanche) |
ostéopénie |
|
T-score < -25 (hanche) |
ostéoporose |
|
T-score < -25 (hanche) + 1 ou plusieurs fractures par fragilité osseuse |
ostéoporose sévère |
L’utilisation des critères de l’OMS n’est pas bien validée chez l’homme même si plusieurs études ont montré que les mêmes seuils pouvaient être utilisés étant donné que le risque fracturaire était similaire entre les deux sexes pour les mêmes valeurs de DMO (en tout cas pour les fractures de hanche).
L’ostéoporose peut être primitive ou secondaire :
1. ostéoporose primitive :
· Type I : post-ménopausique elle touche surtout l’os trabéculaire et se manifeste par des fractures du poignet (Pouteau-Colles) ou des fractures vertébrales.
· Type II : sénile elle touche les deux sexes avec l'avancement de l'âge et se manifeste par des fractures du col fémoral essentiellement.
2. ostéoporose secondaire :
· Les Médicaments : la corticothérapie est l’étiologie la plus fréquente. Des recommandations préventives existent pour chaque traitement corticoïde instauré à une dose > 75 mg/ jour et pour une durée > 3 mois [6]. Il y aussi l’héparinothérapie au long cours.
· Les endocrinopathies : les hypogonadismes l’hypercorticisme l’hyperthyroïdie l’hyperparathyroïdie le diabète de type 1 l’hyperprolactinémie l’acromégalie…
· Les rhumatismes inflammatoires chroniques : la polyarthrite rhumatoïde la spondylarthrite ankylosante et le lupus érythémateux aigu disséminé essentiellement [7-10]. Plusieurs études ont démontré une ostéoporose précoce et indépendante de toute corticothérapie qui vient souvent comme facteur aggravant.
· Autres : anorexie mentale alcoolisme tabagisme chronique…
|
Sexe féminin |
|
Ménopause précoce |
|
Age* |
|
Aménorrhée primaire ou secondaire |
|
Hypogonadisme primaire ou secondaire chez l’homme |
|
Origine ethnique blanche ou asiatique |
|
Antécédent personnel de fracture par fragilité osseuse* |
|
Densité minérale osseuse (DMO) diminuée |
|
Traitement corticoïde |
|
Remodelage osseux augmenté* |
|
Antécédent familial de fracture de hanche |
|
Faible acuité visuelle* |
|
Faible poids du corps* |
|
Maladies neuromusculaires* |
|
Tabagisme* |
|
Consommation excessive d’alcool |
|
Immobilisation prolongée |
|
Régime pauvre en calcium |
|
Déficit en vitamine D |
* facteurs de risque de fracture indépendants de la DMO.
L'os est un tissu vivant. Il est en perpétuel remaniement. Deux types de cellules assurent des fonctions opposées et coordonnées. Les ostéoclastes détruisent le tissu osseux (ostéorésorption) alors que les ostéoblastes édifient le nouvel os et réparent les lacunes récemment résorbées (ostéoformation). L'ensemble de ces phénomènes constitue le remodelage osseux. L'équilibre est assuré par plusieurs facteurs. Parmi ceux-ci les hormones (en particulier les œstrogènes) jouent un rôle déterminant. Toutes les maladies osseuses sont dues à un dysfonctionnement pathologique du remodelage osseux. Au cours des dernières années des progrès considérables ont été réalisés dans la compréhension des mécanismes qui aboutissent à l'ostéoporose. Les modifications observées au cours de cette maladie sont schématiquement de deux types :
- baisse de la masse osseuse les mécanismes de destruction osseuse l'emportant sur ceux de la construction
- et les changements spécifiques dans la microarchitecture osseuse


Courbe d’évolution de la masse osseuse en fonction de l’âge dans la population marocaine au rachis (a) et à la hanche (b) comparée aux populations occidentales et arabes..
La masse osseuse globale atteint son maximum environ 10 ans après la fin de la croissance (pic de masse osseuse ou peak bone mass) et commence à décliner après une phase en plateau pendant la quatrième décennie. Elle diminue de la moitié de sa valeur maximale vers l'âge de 80 ans. Le pic de masse osseuse qui est atteint à la trentaine est moins élevé chez les femmes que chez les hommes. Les femmes présentent une accélération de leur perte osseuse dans les années qui suivent la ménopause. On estime que la moitié de la perte osseuse chez elles est due à l'arrêt de la fonction ovarienne et l'autre moitié au vieillissement.
L'os du squelette adulte est constitué d'os cortical (ou compact) et d'os spongieux (ou trabéculaire). Les proportions d'os cortical et spongieux varient selon le site squelettique où se produisent les fractures ostéoporotiques les plus fréquentes. L'os spongieux est prédominant au rachis lombaire alors qu'il ne représente que la moitié de la zone intertrochantérienne du fémur et uniquement 25% du col fémoral. Il est par ailleurs démontré que l'os cortical et l'os spongieux n'évoluent pas de la même manière avec l'âge. Ces phénomènes expliquent les différences de l'âge de survenue des fractures ostéoporotiques selon les sites (vertèbres fémur…). D'autres paramètres influencent l'intégrité du squelette: la sénescence des cellules osseuses l'alimentation les facteurs génétiques et environnementaux…
Hormis la masse osseuse la genèse des fractures ostéoporotiques fait également intervenir:
- la géométrie du col fémoral qui joue un rôle dans la résistance mécanique de ce segment et constitue un élément prédictif des fractures de l'extrémité supérieure du fémur.
- Les altérations neuromusculaires et de l'équilibre postural ainsi que celles de la vue participent à l'accroissement du risque de chutes.
- La diminution de la masse musculaire avec l'âge et la réduction de l'absorption de l'énergie du choc lors de la chute constituent d'autres facteurs du risque fracturaire.
La prévention commence dès l'enfance ! Un régime alimentaire équilibré riche en calcium et des exercices physiques réguliers permettent d’augmenter de façon importante la masse osseuse et réaliser ainsi un important capital osseux. Ces conseils d’hygiène de vie sont d’ailleurs valables à tout âge.
Non. L’ostéoporose est asymptomatique. Elle peut devenir douloureuse en cas de fractures dont certaines peuvent passer inaperçues (fractures vertébrales par exemple à l’origine de douleurs dorsales).
Il faut réaliser une mesure de la mesure de la densité minérale osseuse devant les situations suivantes :
| Facteurs de risque forts : |
|
- Statut hormonal |
|
Ménopause précoce (< 45 ans) |
|
Aménorrhée secondaire (> 1 an) |
|
Hypogonadisme primitif |
|
- Corticothérapie au long cours (> 75 mg/j de prednisone ou équivalent plus de 3 mois) |
|
- Antécédent familial de fracture de hanche chez la mère |
|
- Faible indice de masse corporelle (<19 Kg/m2) |
|
- Autres maladies : |
|
Anorexie mentale |
|
Syndromes de malabsorption (hépatopathies chroniques maladie caeliaque entérocolopathies inflammatoires…) |
|
Insuffisance rénale chronique |
|
Hyperparathyroïdie primitive |
|
Hyperthyroïdie |
|
Syndrome de Cushing |
|
Immobilisation prolongée |
| Aspect radiographique de déminéralisation diffuse ou de déformation vertébrale ou les deux |
| Antécédent personnel de fracture par fragilité osseuse (poignet rachis hanche côte...) |
| Perte de taille cyphose dorsale (après confirmation de déformation vertébrale) |
Les techniques de mesure de la DMO sont nombreuses mais la technique de référence est actuellement l’absorptiométrie biphotonique à rayons X ou DXA.
Comparaison entre plusieurs techniques de mesure de la masse osseuse.
|
Technique |
Sites |
Reproductibilité (%) |
Précision (%) |
Temps d’examen (min) |
Dose irradiante (mRem) |
Coût (DH) |
|
Absorptiométrie monophotonique à rayons X |
Radius Calcanéum |
05-2 |
3-5 |
10-15 |
5-10 |
- |
|
Absorptiométrie biphotonique |
Rachis lombaire Hanche Corps entier |
2-4 |
4-10 |
20-40 |
5 |
- |
|
Absorptiométrie biphotonique à rayons X (DXA) |
Rachis lombaire Hanche Corps entier |
05-2 |
3-10 |
1-15 |
1-30 |
400-800 |
|
Tomodensitométrie quantitative (QCT) |
Rachis |
2-5 |
5-20 |
10-20 |
100-1000 |
700-1500 |
Non. A 50 ans la proportion de femmes qui vont avoir une fracture ostéoporotique (poignet rachis hanche) dans les 10 années suivantes est d’environ 45% (valeur prédictive positive). Le taux de détection de ces fractures est cependant très faible (sensibilité) : c’est ainsi que 96% des fractures surviendront chez des femmes sans ostéoporose puisqu’une mesure systématique à cet âge montre une prévalence d’ostéoporose de 4% (figure). Cette faible sensibilité est une des principales causes qui font qu’il n’est pas recommandé de faire un dépistage systématique de l’OP à la ménopause.
 adapté de Kanis et al (5)
adapté de Kanis et al (5)
Distribution de la masse osseuse chez les femmes en fonction de l’âge et prévalence de l’ostéoporose (en bleu).
Non. Il existe pour l’ostéoporose un axe Nord-Sud. L’ostéoporose est en effet beaucoup plus rare en Afrique noire mais ce sont les études conduites aux états-Unis qui montrent cette particularité chez les américains de race noire. Ceux-ci ont un capital osseux supérieur à celui des patients de race blanche même à des âges avancés. Des études comparatives ont montré qu’en Amérique du Nord les femmes noires ont par rapport aux blanches un contenu minéral osseux de 5 à 10% plus élevé et une densité osseuse plus élevée de 5% et ceci dans les mêmes sites de mesure et aux mêmes âges.
L'épidémiologie de la fracture de la hanche (complication la plus redoutable de l'ostéoporose) utilisée comme indicateur de l'épidémiologie de l'ostéoporose dans le monde démontre aussi ces faits.
Tableau : Incidence (pour 100 000/an) des fractures de la hanche chez les personnes âgées de plus de 50 ans dans les différentes populations.
|
Localisation géographique |
Année de l’étude |
Femmes |
Hommes |
Femme/Homme |
|
Asie |
||||
|
Hong Kong |
1985 |
353 |
181 |
2.0 |
|
Tottori préfecture Japon |
1986–1987 |
202 |
73 |
2.8 |
|
Honam Corée |
1991 |
41 |
48 |
0.8 |
|
Beijing RP China |
1990–1992 |
85 |
80 |
1.0 |
|
Shenyang RP China |
1994 |
87 |
100 |
0.8 |
|
Koweït |
1998 |
295 |
200 |
1.5 |
|
Singapoure |
1991–1998 |
402 |
152 |
2.6 |
|
Océanie |
||||
|
Nouvelle Zélande (Blancs) |
1973 – 1976 |
620 |
151 |
4.1 |
|
Nouvelle Zélande (Maori) |
1973 – 1976 |
107 |
182 |
0.6 |
|
Australie |
1989-1990 |
500 |
182 |
2.7 |
|
USA |
||||
|
Rochester |
1965-1974 |
510 |
174 |
2.9 |
|
Californie (Caucasiens) |
1983-1984 |
617 |
215 |
2.9 |
|
Californie (Noirs) |
1983-1984 |
241 |
153 |
1.6 |
|
Californie (Hispaniques) |
1983-1984 |
219 |
97 |
2.3 |
|
Californie (Asiatiques) |
1983-1984 |
383 |
116 |
3.3 |
|
Etats-Unis |
1989 |
506 |
179 |
2.8 |
|
Amérique du Sud |
||||
|
La Platt Argentine |
1989-1990 |
513 |
122 |
4.2 |
|
Europe |
||||
|
Southampton UK |
1986 |
262 |
72 |
3.6 |
|
Crete |
1986 |
394 |
179 |
2.2 |
|
Hollande |
1987 |
393 |
154 |
2.6 |
|
Genève Suisse |
1987 |
405 |
127 |
3.2 |
|
Oslo Norvège |
1989 |
903 |
384 |
2.3 |
|
Italie |
1990 |
232 |
81 |
2.8 |
|
Porto Portugal |
1988–1989 |
423 |
155 |
2.7 |
|
Canton of Vaud Suisse |
1991 |
494 |
170 |
2.9 |
|
Afrique |
||||
|
Bantu Afrique du sud |
1959 – 1964 |
26 |
38 |
0.7 |
|
Rabat Maroc |
2002 |
80 |
58 |
1.3 |
Incidence standardisée ajustée à la population américaine blanche de 1985 âgée de plus 50 ans.
L’estimation du risque de fracture par la mesure de la densité minérale osseuse (DMO) est analogue à l’estimation du risque d’accident vasculaire cérébral (AVC) par la mesure de la tension artérielle (TA). La TA et la DMO sont deux variables normalement distribués dans la population générale. De même qu’un patient est considéré comme hypertendu au delà d’un certain seuil le diagnostic d’ostéoporose est posé lorsque la DMO est sous un certain seuil. De la même manière et dans les deux cas il n’existe pas un seuil parfaitement discriminant pour distinguer les patients qui présenteront ou non dans l’avenir un événement clinique (AVC ou fracture). Cependant la capacité de prédire une fracture de hanche par la mesure de la DMO est au moins aussi bonne que celle de la TA de prédire un AVC et supérieure à celle de la cholestérolémie pour prédire un accident coronarien. Mais il faut garder à l’esprit qu’une mesure normale n’est pas une garantie contre la survenue d’une fracture mais veut seulement dire que le risque est réduit et qu’une DMO dans la fourche « ostéoporose » veut dire que le risque de fracture est plus élevé.
Le traitement de l’ostéoporose a un seul objectif : la prévention des fractures qu’il s’agisse de la première fracture après un diagnostic préfracturaire fondé sur une mesure de la densité minérale osseuse (DMO) abaissée ou des fractures incidentes postérieurement à la première.
Le traitement hormonal substitutif (THS) est le meilleur traitement préventif quand il existe un déficit gonadique. Chez la femme plusieurs études l’ont largement démontré. Les estrogènes réduisent l’activité du remodelage osseux et en particulier la résorption osseuse. Ils stoppent la perte osseuse et permettent un regain de densité minérale osseuse. Depuis plus d’un an l’utilisation du THS connaît une large polémique après la publication d’études dont la plus importante est l’étude WHI démontrant un déséquilibre dans son rapport bénéfice risque en sa défaveur (risques de cancer du sein d’accidents cardiovasculaires et thromboemboliques et même de démence augmentés) (Tableau). Plusieurs critiques méthodologiques peuvent cependant être faites sur cette étude dont la plus importante est que ces résultats sont spécifiques de la population américaine qui a reçu un traitement associant des estrogènes conjugués équins et de l'acétate de médroxyprogestérone tous les jours schéma thérapeutique qui n'a rien d'un traitement hormonal substitutif classique tel qu’il est utilisé au Maroc ni par les molécules utilisées ni par leur voie et leur mode d'administration. Quant à la population étudiée cette cohorte âgée en moyenne de 63 ans dont plus d'un tiers avait une obésité et dont 16 % avait déjà reçu un traitement hormonal ne peut être considérée comme représentative des femmes vues en début de ménopause pour une stratégie de prévention primaire. Pour ceux qui préfèrent privilégier la prudence en attendant d’autres études la seule indication actuellement unanimement admise reste le traitement symptomatique des facteurs climatériques associées à la ménopause pendant les deux premières années.
Effets d’un traitement de cinq ans par 0625 mg/j d’estrogènes conjugués équins et 25 mg/j d’acétate de medroxyprogestérone (16 608 femmes de 50 à 79 ans : étude WHI).
|
Risque relatif (intervalle de confiance à 95 %) |
Risque absolu en excès pour 10 000 femme-années |
|
|
Embolie pulmonaire |
213 (139 - 325) |
+ 8 |
|
Accident vasculaire cérébral |
141 (107 - 185) |
+ 8 |
|
Maladie coronarienne |
129 (102 - 163) |
+ 7 |
|
Cancer du sein invasif |
126 (100 - 159) |
+ 8 |
|
Cancer de l’endomètre |
083* (047 - 147) |
/ |
|
Cancer colorectal |
063 (043 - 092) |
– 6 |
|
Fractures de la hanche |
066 (045 - 098) |
– 5 |
|
Démence probable |
205 (121 - 348) |
+ 23 |
|
Mortalité globale |
098* (082 - 118) |
/ |
* non significatif.
La tibolone (livial®) est un stéroïde de synthèse dont la molécule est proche de celle des progestatifs (19-norsteroïde). Ses métabolites peuvent avoir des effets estrogéniques (dans l’os) progestatifs ou androgéniques en fonction des tissus. L’Agence française de sécurité sanitaire des produits de santé (Afssaps) vient d’être informée de la décision prise par le laboratoire Organon® d’arrêter l’essai clinique LIFT sur la tibolone (Livial®) qui était destiné à évaluer l’efficacité de la spécialité Livial® dans la réduction de nouvelles fractures vertébrales chez des femmes atteintes d’ostéoporose âgées de plus de 60 ans. L’étude montre une réduction de 50% du risque de fracture vertébrale. Toutefois elle met également en évidence une augmentation significative du risque d’accident vasculaire cérébral. En France Livial® n’a d’indication ni dans la prévention ni dans le traitement de l’ostéoporose.
Le raloxifène (Evista*) est un modulateur spécifique de l’activation des récepteurs des estrogènes (SERM : selective estrogen receptor modulator) agoniste sur l’os et le métabolisme lipidique antagoniste sur les cellules mammaires et endométriales. En d’autres termes il a un effet bénéfique sur l’os sans avoir les effets négatifs du traitement hormonal substitutif (THS) sur le sein et l’utérus. Il prévient la perte osseuse post-ménopausique précoce et réduit le risque de fracture vertébrale chez des femmes ostéoporotiques. Il n’a pas été montré d’effet anti-fracturaire sur les os périphériques en particulier sur le fémur. Le risque de cancer du sein à cour terme est nettement diminué mais à long terme à l’arrêt du traitement il n’a pas été étudié. Le raloxifène diminue les taux sériques de cholestérol et de LDL et n’augmenterait pas le risque vasculaire artériel ; ce point est en cours d’étude. Il n’y a pas d’effet néfaste endométrial connu. Il existe une augmentation du risque thromboembolique veineux comparable à celui connu pour le THS. Les bouffées de chaleur et les crampes des jambes sont plus fréquentes chez les femmes recevant ce traitement. Dans la plupart des cas cependant ces symptômes ne justifient pas son arrêt. Ce médicament n’est pas encore commercialisé au Maroc.
Un supplément calcique est conseillé lorsque le régime alimentaire apporte moins de 700 mg/j environ. Il peut être de 500 ou 1000 mg/j suivant le degré d’insuffisance calcique. Un supplément vitaminique D de 400 ou 800 UI doit également être prescrit. La prise de vitamine D à forte dose (600000 UI) peut être préconisée pour corriger une hypovitaminose D.
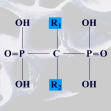
Ce sont des analogues structuraux du pyrophosphate caractérisés par leur forte affinité osseuse et leur très faible absorption par voie orale (1 à 3 %). Ce sont de puissants inhibiteurs de la résorption osseuse. Les précautions d’administration sont indispensables afin de limiter les risques d’événements secondaires digestifs.
· l’étidronate (Didronel*) était prescrit deux semaines chaque trimestre à la dose de 400 mg/jour en alternance avec un supplément calcique de 500 mg/jour. Le niveau de preuve apportée par cette molécule est inférieur à celui apporté par les autres bisphosphonates et il n’a pas d’effet démontré sur l’incidence des fractures périphériques. Il ne doit plus être prescrit actuellement.
· l’alendronate (Fosamax* Fosavance* acide alendronique GT*) prescrit en continu en administration hebdomadaire de 70 mg/semaine il a montré qu’il avait un effet anti-fracturaire significatif. Il est efficace à la fois dans l’ostéoporose pré-fracturaire et l’ostéoporose sévère.
· le risédronate (Actonel*) a prouvé son efficacité comme traitement préventif et curatif de l’ostéoporose. La dose est de 35 mg/semaine.
L’alendronate et le risédronate doivent être ingérés le matin 30 minutes au moins avant la première prise alimentaire ou de boissons avec un grand verre d’eau du fait de leur faible absorption. Quelques rares cas d’oesophagite sévère ont été signalés depuis leur commercialisation. Ils sont contre-indiqués en cas de reflux oesophagien.
· d’autres bisphosphonates (tiludronate ibandronate pamidronate zolédronate) sont en cours d’évaluation pour le traitement de l’ostéoporose. L'ibandronate (Bonviva*) a démontré une efficacité anti-fracturaire vertébrale mais non périphérique en administration orale mensuelle (150 mg). Le zolédronate (Aclasta*) vient de démontrer dans une étude de grande envergure son efficacité anti-fracturaire vertébrale et périphérique à la dose de 5 mg en perfusion une fois par an.
La durée des traitements anti-ostéoporotiques n’est pas connue et affaire d’adaptation individuelle. Si l’on admet que les bisphosphonates agissent essentiellement par l’augmentation de la minéralisation secondaire une durée de cinq ans pourrait être optimale.
Ils devraient être capables d’augmenter la masse osseuse sans altérer la qualité de l’os et donc de réduire la probabilité de survenue des fractures. Ils sont malheureusement peu nombreux.
· les sels de fluor (fluorure de sodium et monofluorophosphate) stimulent la multiplication des ostéoblastes et accroissent fortement le volume trabéculaire osseux et la densité minérale osseuse vertébrale. Dans l’ostéoporose vertébrale fracturaire les effets ne s’accompagnent pas d’une réduction de l’incidence des nouvelles fractures vertébrales lors d’essais contrôlés en double aveugle avec des posologies de 50 à 75 mg/jour de fluorure de sodium ou de 150 à 200 mg/jour de monofluorophosphate pendant deux à quatre ans en association avec un supplément calcique et vitaminique D. C’est donc un traitement complètement abandonné de nos jours.
· L’hormone parathyroïdienne (Teriparatide: Forsteo®) stimule l’ostéoformation au niveau de l’os spongieux et a donné des résultats très prometteurs. L’administration de fragment 134 de PTH humaine (20 µg en injection sous cutanée quotidienne) diminue le risque de fracture vertébrale et non-vertébrale de 65 et 53 % respectivement chez les femmes ménopausées ostéoporotiques ayant des fractures vertébrales prévalentes. L’augmentation de densité osseuse provoquée pour cet agent anabolique a été de 9 % au rachis et 3 % au col fémoral. Ces résultats ont été obtenus après un suivi médian de 19 mois. Son coût élevé (500 euros/mois environ) en limite actuellement l'utilisation aux formes très sévères d'ostéoporose (au moins 3 fractures vertébrales).
· Le ranelate de strontium (Protos*) dans des modèles animaux et in vitro diminue la résorption osseuse et stimule l’ostéoformation. Il a un effet favorable sur la densité osseuse chez les femmes récemment ménopausées et chez les femmes ostéoporotiques. À la dose de 2 g/j il réduit de 41 % le risque de fracture vertébrale des la première année et sur trois ans chez les femmes ostéoporotiques ayant des fractures vertébrales prévalentes.
Dans la pratique clinique l’évolution densitométrique est couramment utilisée. Son interprétation est toutefois difficile en raison de la variabilité de la mesure ; le délai à respecter entre deux mesures doit être au minimum de deux ans voire plus chez les patients ostéoporotiques. Le bénéfice anti-fracturaire des traitements est observé dès la première année alors que l’effet densitométrique n’est pas encore maximal. Bien qu’aucune étude ne compare les trois molécules au sein d’un même protocole on constate que le bénéfice anti-fracturaire vertébral est du même ordre pour le raloxifène l’alendronate et le risédronate alors que les variations densitométriques sont différentes. Finalement la valeur densitométrique de début de traitement est un déterminant d’incidence fracturaire plus important que la variation de densité sous traitement. Sur ces arguments il n’est pas recommandé d’utiliser la densitométrie pour l’adaptation des traitements à court terme.
· La prévention primaire : elle commence à l’adolescence ! un régime alimentaire équilibré riche en calcium et des exercices physiques réguliers permettent d’augmenter de façon importante la masse osseuse et réaliser ainsi un important capital osseux. Ces conseils d’hygiène de vie sont d’ailleurs valables à tout âge.
· La prévention secondaire : à la ménopause si le THS est indiqué et suivi aux doses recommandées pour la prévention osseuse il n’est pas utile de pratiquer systématiquement une densitométrie. Sinon il est recommandé de rechercher les facteurs de risque d’ostéoporose et de discuter l’indication d’une densitométrie en fonction de ces facteurs de risque (Tableau : question sur les indications de l’ostéodensitométrie) :
– si T ≤ –25 : un traitement peut être recommandé d’autant plus que la densité est plus basse et le nombre de facteurs de risque élevé. Peuvent être utilisés le raloxifène 60 mg/j l’alendronate 10 mg/j ou 70 mg/semaine le risédronate 5 mg/j ou 35 mg/semaine. Dans le choix on tiendra compte des effets extra-osseux des traitements de l’âge et du risque de fracture périphérique ;
– si –25 < T ≤ –1 : un traitement systématique n’est pas recommandé. Le risque d’évolution vers une ostéoporose existe d’autant plus que la patiente est plus jeune. L’évaluation individuelle des facteurs de risque associés les effets extra-osseux et les contraintes des traitements doivent être pris en compte. En l’absence de traitement la situation peut être ré-analysée sur la base d’une deuxième densitométrie pratiquée après trois à cinq ans.
· La prévention tertiaire : c’est la mise en place d’un traitement après la survenue d’une fracture. Les fractures ostéoporotiques peuvent concerner tous les os sauf le crâne le rachis cervical les mains et les orteils. Il est recommandé de pratiquer une densitométrie pour quantifier la diminution de la densité osseuse :
– si T > –1 : il faut rediscuter l’origine ostéoporotique de la fracture. Aucun essai thérapeutique n’a été conduit dans cette population ;
– si T ≤ –25 : un traitement est recommandé ; il peut s’agir du raloxifène 60 mg ou l’alendronate (10 mg/j ou 70 mg hebdomadaires) ou le risédronate (5 mg/j ou 35 mg hebdomadaires). L’étidronate est une alternative si la fracture est vertébrale. Le raloxifène sera envisagé surtout chez les femmes ayant une ostéoporose à prédominance rachidienne. Les bisphosphonates peuvent être utilisés dans tous les cas y compris quand le risque de fracture périphérique (par exemple de l’extrémité supérieure du fémur) est au premier plan
– si –25 < T ≤ –1 : si la fracture est vertébrale un traitement est indiqué (voir ci-dessus) ; sinon on évaluera au niveau individuel le bénéfice du traitement en fonction de la densité osseuse des circonstances de survenue de la fracture (simple chute de sa hauteur) et de sa localisation (les fractures du poignet et de l’extrémité supérieure du fémur augmentent le risque de survenue d’autres fractures).
Les fractures ostéoporotiques peuvent concerner tous les os sauf le crâne le rachis cervical les mains et les orteils. Parmi 100 femmes atteignant l’âge de 50 ans 40 présenteront avant la fin de leur vie une fracture par fragilité touchant les vertèbres l’extrémité supérieure du fémur ou le poignet. Ces trois sites sont les plus fréquemment concernés par les fractures mais d’autres fractures extravertébrales (humérus os de la jambe bassin sacrum côtes...) ne sont pas rares. L’incidence de ces fractures est chez l’homme à âge égal moitié moindre que chez la femme.
La fracture vertébrale (par tassement partiel ou total) est la fracture ostéoporotique la plus fréquente. Elle peut survenir même en l'absence de traumatisme important. Elle engendre habituellement des rachialgies intenses qui durent de quelques jours à quelques semaines avant de s'atténuer pour laisser des douleurs mécaniques chroniques. Tout nouveau tassement entraîne une recrudescence des douleurs obligeant souvent l'alitement. Cependant les fractures vertébrales peuvent être insidieux et ne se manifester que par la perte de taille et la cyphose dorsale secondaire.
La fracture du poignet est très commune chez la femme. Elle nécessite habituellement une réduction orthopédique et une immobilisation plâtrée de plusieurs semaines. Les complications ne sont pas rares (algodystrophie raideur résiduelle…) et la récupération fonctionnelle est souvent incomplète.
La fracture du col fémoral est la complication la plus redoutable de l'ostéoporose. Dans la majorité des cas le patient n'a fait qu'une simple chute de sa hauteur. L'hospitalisation et dans la plus part des cas une intervention chirurgicale sont rendues nécessaires. S'agissant de personnes âgées les complications sont fréquentes. La mortalité peut atteindre 20% dans les mois qui suivent la fracture et la rééducation ne parvient pas toujours à éviter une perte d'autonomie plus ou moins importante.
Sources alimentaires de calcium
|
Laits et laitages |
Teneur en mg |
Autres |
Teneur en mg |
|
Lait entier |
120 |
Eaux minérales (100 ml) |
|
|
Lait ½ écrémé |
115 |
Sidi Ali |
12 |
|
Lait écrémé |
110 |
Sidi Harazem |
12 |
|
Lait (un bol de 300 mL) |
350 |
Ain Saïs |
12 |
|
Yoghourt |
120-170 |
Safia |
12 |
|
Yoghout à boire |
110-120 |
Oulmès |
150 |
|
Petit suisse |
90-110 |
Evian |
78 |
|
Fromage blanc frais |
80-250 |
Volvic |
10 |
|
Fromage à pâte molle |
120-500 |
Peu minéralisées |
6-8 |
|
Brie |
120 |
Aliments |
|
|
Chèvres |
100-200 |
Poissons (usuels) |
20-50 |
|
Camemberts |
400 |
sardines |
80-100 |
|
Fromage à pâte dure |
500-1200 |
Œufs (2 œufs=110-140 g) |
50-60 |
|
Bleus |
400-700 |
Légumes |
10-20 |
|
Cantals |
800-900 |
Viandes |
< 10 |
|
Emmental édam ... |
900-1200 |
Apports recommandés en calcium
|
AGE |
APPORTS (mg/j) |
|
ENFANTS |
|
|
0-6 mois |
360 |
|
6-12 mois |
540 |
|
1-3 ans |
600 |
|
3-9 ans |
700 |
|
9-12 ans |
800 |
|
ADOLESCENTS |
|
|
Filles |
1200 à 1400 |
|
Garçons |
800 à 1000 |
|
ADULTES |
|
|
Hommes |
800 |
|
Femmes |
|
|
25-45 ans |
800-1000 |
|
Grossesse et allaitement |
1200 à 1400 |
|
Ménopause |
1400-1500 |
|
âgée |
1200 |
Les corticoïdes sont prescrits au long cours par un très grand nombre de médecins pour des pathologies très diverses (rhumatismes inflammatoires chroniques asthme et pathologies allergiques maladies dysimmunitaires…). Ils constituent lorsqu’ils sont administrés au long cours (plus de 75 mg/j d’équivalent-prednisone pendant plus de 3 mois) la première cause des ostéoporoses secondaires. Quand on sait que 05 à 09% de la population générale est exposée à un traitement cortisonique par voie générale au long cours selon les études récentes et que moins de 10% d’entre eux bénéficient d’un traitement préventif de l’OP on peut se rendre compte de l’ampleur du problème.
28. Quel est le risque fracturaire sous corticothérapie ?
Après instauration d’un traitement corticoïde au long cours (plus de 75 mg/j d’équivalent-prednisone pendant plus de 3 mois):
La perte osseuse est plus importante sur l’os trabéculaire (d’abord rapide jusqu'à 10 à 20% en 3 à 6 mois puis lente d’environ 2%/an) alors que sur l’os cortical la perte est plus lente (2 – 3%/an).
Le risque de fracture vertébrale est multiplié par 3 à 5
Le risque de fracture du col fémoral est multiplié par 15
Il est évident que chaque patient recevant une corticothérapie prolongée va perdre de l’os. Cependant cette perte reste très variable d’un patient à l’autre et tous ne feront pas une fracture. Quelques facteurs de risque de fracture peuvent néanmoins être dégagés :
1. la DMO avant le début de la corticothérapie : le risque est plus important si la DMO est déjà basse avant le début du traitement corticoïde. C’est le cas des femmes ménopausées et des hommes ayant un hypogonadisme.
2. la dose de corticoïdes : il est maintenant établi que la perte osseuse est dose et durée dépendante et qu’elle est plus rapide les six premiers mois du traitement corticoïde. La dose cumulative affecte aussi la sévérité de la perte osseuse. il n’ y a pas de consensus concernant une dose de sécurité mais plusieurs études semblent s’accorder qu’au dessous de 5 mg par jour de prednisone le risque d’OP est minime.
3. la maladie sous-jacente : une prévalence de fractures de 50% a été observée chez des patients ayant une polyarthrite rhumatoïde (PR) sous corticothérapie au long cours alors qu’elle n’était que de 11% chez des asthmatiques. Les maladies inflammatoires entraînent une augmentation du remodelage osseux corrélée à l’activité de la maladie.
4. le risque de chute : le risque de fracture est plus élevé chez des patients âgés sous benzodiazépines ou à faible acuité visuelle.
La DMO n’explique que 40% du risque de fracture les 60% restants s’expliquent par les autres facteurs.
Il n’est pas possible de prédire le risque pour un individu donné. La mesure de la DMO avant le début du traitement avec éventuellement un contrôle après 6 mois pourrait être le meilleur indicateur du risque individuel.
Toutes les recommandations publiées concernant la prévention de l’OP cortisonique préconisent la mesure de la DMO avant l’initiation d’un traitement cortisonique au long cours. La mesure pourra éventuellement être répétée à 6 mois pour évaluer l’importance de la perte osseuse. Chez les patients recevant un traitement préventif de l’OP une mesure annuelle est suffisante.
Chaque fois qu’une corticothérapie supérieure à 5 mg par jour en équivalent prednisone est envisagée pour plus de trois mois les mesures suivantes doivent être prises avant le début du traitement:
Prescrire le corticoïde à la dose minimale possible et envisager d’arrêter dès que possible.
Essayer d’arrêter le potentiel évolutif de la maladie sous jacente en utilisant un traitement de fond quand il existe.
Conseiller l’arrêt du tabac et de l’alcool.
Conseiller une activité physique régulière.
Eviter les facteurs de risque de chute.
La DMO doit obligatoirement être mesurée au rachis et/ou au col fémoral :
Démarrer une supplémentation en calcium (1 g/j) et en vitamine D (800 UI de vitamine D naturelle 1 mg/j d’alfacalcidiol ou 05 mg/j de calcitriol).
Prescrire un bisphosphonate si :
- T score <-15
- Age >65 ans
- antécédent de fracture par fragilité osseuse.
- Ce traitement devra être poursuivi tant que la corticothérapie est nécessaire.
- Si la DMO est normale il faut surveiller et répéter la mesure une fois par an ou tous les six mois s’il existe d’autres facteurs de risque d’OP.
L’os est en perpétuel renouvellement et c’est un déséquilibre de la balance résorption/formation qui est à l’origine de l’ostéoporose. Ces deux processus peuvent être actuellement évalués par différents marqueurs témoins directs ou indirects de l’activité des ostéoblastes et des ostéoclastes. Les examens standard sont habituellement normaux (calcémie phosphorémie phosphatases alcalines vitamine D parathormone hydroxyprolinurie). Par contre des marqueurs plus sensibles et plus spécifiques du remodelage osseux ont été développés récemment : l’ostéocalcine sérique la phosphatase alcaline osseuse la pyridinoline et la déoxypyridinoline libres urinaires les télopeptides C et N-terminaux du collagène au niveau sérique et urinaire (tableau ).
- L’ostéocalcine plasmatique : Elle fait partie avec la phosphatase alcaline totale et la phosphatase alcaline osseuse des marqueurs biochimiques de la formation osseuse. c’est une protéine synthétisée par les ostéoblastes pour être incorporée dans la matrice osseuse. Elle apparaît donc comme étant un marqueur spécifique de la formation quand il existe un déséquilibre de la balance résorption/formation.
- La phosphatase alcaline osseuse : Il s’agit de l’isoenzyme osseux de la phosphatase alcaline. Son dosage est plus sensible et permet une meilleure caractérisation des patients ainsi qu’un meilleur suivi du traitement.
- Les télopeptides C et N-terminaux (CTX NTX) la pyridinoline et la déoxypyridinoline : Ce sont les molécules de pontage du collagène ou « cross links » urinaires. Ces molécules font partie avec la phosphatase acide plasmatique (résistante à l’acide tartrique) et l’hydroxyproline urinaire des marqueurs biochimiques de la résorption osseuse. Les données cliniques actuelles font de ces molécules les marqueurs les plus sensibles de la résorption osseuse. Récemment le dosage sérique du CTX a démontré un intérêt réel dans le reflet de la resorption osseuse.
Ces marqueurs peuvent permettre de mieux évaluer la vitesse de la perte osseuse et l’efficacité des traitements. Le remodelage osseux ayant une influence directe sur l’ostéoporose par la balance résorption/formation on a donc cherché à mesurer l’intensité de ces deux phénomènes par la mesure de l’apparition dans le sang ou les urines de composés résultant de la formation ou de la dégradation de l’os ou par la mesure d’activités enzymatiques impliquées dans les deux phénomènes. Le dosage de ces marqueurs a permis une avancée majeure dans la recherche clinique sur l’ostéoporose mais à l’échelon individuel leur utilité reste à démontrer.
Marqueurs biochimiques du remodelage osseux
|
FORMATION |
RéSORPTION |
|
Sérum |
Plasma/sérum |
|
- Ostéocalcine - Phosphatase alcaline totale et osseuse Propeptides C et N-terminaux du collagène de type I (PICP et PINP) |
- Phosphatase acide résistante à l'acide tartrique - Pyridinoline et désoxypyridinoline libres - Télopeptides C-terminaux (CTX) du collagène de type I |
|
Urine |
|
|
- Pyridinoline et désoxypyridinoline libres - Télopeptides N (NTX) et C-terminaux (CTX) du collagène de type I - Calciurie - Hydroxyprolinurie - Galactosylhydroxylysine |
En gras et souligné sont indiqués les marqueurs les plus performants dans l'ostéoporose.
1. Consensus Development Conference. Diagnosis prophylaxis and treatment of osteoporosis. Am J Med 1993; 94: 646–50. 2. WHO. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis: technical report series 843. Geneva: WHO 1994. 3. Kanis JA Glüer CC for the Committee of Scientific Advisors International Osteoporosis Foundation. An update on the diagnosis and assessment of osteoporosis with densitometry. Osteoporos Int 2000; 11: 192–202. 4. Cummings SR Melton III LJ. Epidemiology and outcomes of osteoporotic fractures. Lancet 2002 ; 359 : 1761-7. 5. Kanis JA. Diagnosis of osteoporosis and assessment of fracture risk. Lancet 2002;359:1929-36 6. El Maghraoui A. l’ostéoporose cortisonique. Espérance Médicale 2003; 10 :195-200 7. El Maghraoui A Borderie D Edouard R Roux C Dougados M. Osteoporosis body composition and bone turnover in ankylosing spondylitis. J Rheumatol 1999 ; 26 : 2205-9 8. Maillefert JF Aho S El Maghraoui A Dougados M Roux C. changes in bone density in patients with ankylosing spondylitis: a two year follow-up study. Osteoporosis Int 2001; 12 : 605-9 9. El Maghraoui A Chaouir S Bezza A Tabache F Abouzahir A Ghafir D Ohayon V Archane MI. Evaluation de la densité minérale osseuse par tomodensitométrie quantitative au cours de la spondylarthrite ankylosante. Rev Mar Rhum 2003 ; 15 :129-3 10. El Maghraoui A. Osteoporosis and ankylosing spondylitis. Bone Joint Spine 2003 (in press) 11. Glüer CC for the International Quantitative Ultrasound Consensus Group. Quantitative ultrasound techniques for the assessment of osteoporosis: expert agreement on current status. J Bone Miner Res 1997; 12: 1280–88. 12. Lang T Augat P Majumdar S Ouyang X Genant HK. Non-invasive assessment of bone density and structure using computed tomography and magnetic resonance. Bone 1998; 2 (suppl): 149–53. 13. Luckey MM Wallenstein S Lapinski R Meier DE. A prospective study of bone loss in African-American and white women A clinical research center study. J Clin Endocrinol Metab 1996; 8: 2948–56. 14. Aloia JFVaswaniAYeh JK Flaster E. Risk for osteoporosis in black women. Calcif Tissue Int 1996; 59: 415–23. 15. Kanis JA Delmas P Burckhardt P et al. Guidelines for diagnosis and management of osteoporosis. Osteoporos Int 1997; 7: 390–406. 16. Orwoll E. Assessing bone density in men. J Bone Miner Res 2000; 15: 1867–70. 17. Selby PL Davies M Adams JE. Do men and women fracture bones at similar bone densities? Osteoporos Int 2000; 11: 153–57. 18. Melton LJ Atkinson EJ O’Connor MK O’Fallon WM Riggs BL. Bone density and fracture risk in men. J Bone Miner Res 1998; 13: 1915–23. 19. Kanis JA Johnell O Oden A Dawson A De Laet C Jonsson B. Ten year probabilities of osteoporotic fractures according to BMD and diagnostic thresholds. Osteoporos Int 2001; 12: 989–95. 20. Delmas PD ed. The use of biochemical markers of bone turnover in the management of post–menopausal osteoporosis. Osteoporosis Int 2000; 11 (suppl 6): S1–76. 21. Compston JE. Risk factors for osteoporosis. Clin Endocrinol 1992; 36: 223–24. 22. National Osteoporosis Foundation. Analyses of the effectiveness and cost of screening and treatment strategies for osteoporosis: a basis for development of practice guidelines. Osteoporos Int 1998; 8 (suppl 4): 1–88. 23. Royal College of Physicians. Clinical guidelines for the prevention and treatment of osteoporosis. London: RCP 1999. 24. Roux C. Traitement médicamenteux des ostéoporoses post-ménopausiques et cortisoniques. Rev Rhum 2002 ; 69 : 971-81 25. Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA 2002; 288: 321-33 26. Delmas PD Bjarnason NH Mitlak BH Ravoux A Shah AS Huster WJ et al. Effects of raloxifene on bone mineral density serum cholesterol concentrations and uterine endometrium in postmenopausal women. N Engl J Med 1997 ; 337 : 1641-7 27. Ettinger B Black DM Mitlak BH Knickerbocker RX Nickelsen T Genant HK et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene : results from a 3-year randomized clinical trial. JAMA 1999 ; 282 : 637-45. 28. Black DM Cummings SR Karpf DB Cauley JA Thompson DE Nevitt MC et al. Randomised trial effect of alendronate on risk of fracture in women with existing vertebral fractures. Lancet 1996 ; 348 : 1535-41. 29. Cummings SR Black DM Thompson DE Applegate WB Barrett-Connor E Musliner T et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures : results from the Fracture Intervention Trial. JAMA 1998 ; 280 : 2077-82. 30. Schnitzer T Bone HG Crepaldi G Adami S MacClung M Kiel D et al. Therapeutic equivalence of alendronate 70mg once-weekly and alendronate 10mg daily in the treatment of osteoporosis. Aging 2000 ; 12 : 1-12. 31. Tonino RP Meunier PJ Emkey R Rodriguez-Portales JA Menkes CJWasnich RD et al. Skeletal benefits of alendronate : 7-year treatment of posmenopausal osteoporotic women. J Clin Endocrinol Metab 2000 ; 85 : 3109-15. 32. Harris ST Watts NB Genant HK McKeener CD Hangartner T Keller M et al. Effects of risedronate treatment on vertebral and nonvertebral fractures in women with postmenopausal osteoporosis : a randomized controlled trial. JAMA 1999 ; 282 : 1344-52. 33. Reginster J Minne HW Sorensen OH Hooper M Roux C Brandi ML et al. Randomized trial of the effects of risedronate on vertebral frctures in women with established postmenopausal osteoporosis. Osteoporos Int 2000 ; 11 : 83-91. 34. McClung MR Geusens P Miller PD Zippel H Bensen WG Roux C et al. Effect of risedronate on the risk of hip fracture in elderly women. N Engl J Med 2001 ; 344 : 333-40. 35. Watts NB Harris ST Genant HK Wasnich RD Miller PD Tackson RD et al. Intermittent cyclical etidronate treatment of postmenopausal osteoporosis. N Engl JMed 1990 ; 323 : 73-9. 36. Harris ST Watts NB Jackson RD Genant HKWasnich RD Ross P et al. Four-year study of intermittent cyclic etidronate treatment of postmenopausal osteoporosis : three years of blinded therapy followed by one year of open therapy. Am J Med 1993 ; 95 : 557-67. 37. Dawson Hughes B Harris SS Krall EA Dallal GE. Effect of calcium and vitamin D supplementation on bone density in men and women 65 years of age or older. N Engl JMed 1997; 337: 670-6. 38. Cummings SR Karpf DB Harris F Genant HK Ensrud K Lacroix AZ et al. Improvement in spine bone density and reduction in risk of vertebral fractures during treatment with antiresorptive drugs. Am J Med 2002; 112: 281-9.
Articles les plus lus
- L'arthrose cervicale
- L'arthrose lombaire
- La spondylarthrite ankylosante
- La fibromyalgie
- Coxarthrose
- Les anti-inflammatoires non stéroïdiens. Modalités de prescription.
- Apport de l’échographie dans le diagnostic d’une épaule douloureuse.
- La gonarthrose
- La maladie de Behçet
- Diagnostic précoce de la polyarthrite rhumatoïde



