Physiopathologie de l'arthrose
- Détails
- Mis à jour le 24 juin 2012
INTRODUCTION
L’arthrose n’est pas une simple usure du cartilage mais un processus actif impliquant toute l’articulation. Si la suppression des propriétés biomécaniques et biologiques du cartilage articulaire est reconnue comme élément majeur de la physiopathologie de l’arthrose la destruction arthrosique du cartilage est le résultat d’un déséquilibre entre anabolisme et catabolisme de la matrice extracellulaire. Ce déséquilibre est accentué par une apoptose chondrocytaire accélérée et par la participation du tissu synovial à l’activation chondrocytaire par libération de nombreux médiateurs. Enfin l’os sous chondral pourrait participer aux phénomènes dégradatifs de la matrice probablement par le biais d’une sécrétion d’enzymes protéolytiques par les cellules osseuses.
Malgré la persistance de nombreuses inconnues dans la physiopathologie de l’arthrose des progrès considérables ont été réalisées ces dernières années et les différents acteurs de la dégradation du cartilage sont mieux connus.
Enfin on constate actuellement un vif intérêt dans la connaissance des mécanismes initiateurs de la maladie.
COMPOSITION DU CARTILAGE ARTICULAIRE
Le cartilage articulaire est un tissu conjonctif essentiellement formé d’eau de protéoglycanes (PG) et de collagène. Les cellules ne représentent qu’environ 1 % du volume du cartilage adulte.
L’eau la plus abondante 80 % dans la couche superficielle et 65 % dans la zone profonde se répartit dans les espaces entre PG et collagène. Elle joue un rôle biomécanique par transport de solutés et lubrification articulaire. La matrice aqueuse contrôle la résistance à la pression et la déformation réversible du cartilage. Le collagène dont 90 à 92 % de type II est responsable de la rigidité. La concentration des PG est variable. L’interaction entre collagène et réseau de PG assure rigidité et cohésion de la matrice extracellulaire celle entre les larges PG agglomérés et la matrice aqueuse contribue significativement à la résistance du cartilage à la compression. Le maintien du cartilage dépend d’échanges complexes continus entre les chondrocytes et la matrice dont ils assurent la synthèse.
STRUCTURE DU CARTILAGE ARTICULAIRE
Dans l’optique de la constitution du cartilage les chondrocytes organisent les fibres collagènes les protéoglycanes et les protéines non collagènes en une structure unique hautement différenciée.
La composition l’organisation les propriétés mécaniques de la matrice la morphologie cellulaire probablement la fonction cellulaire dépendent de la profondeur de ces éléments par rapport à la surface articulaire.
De la surface à la profondeur s’observe une variation de la forme de la taille des cellules de l’orientation des fibres collagènes du contenu en eau et PG.
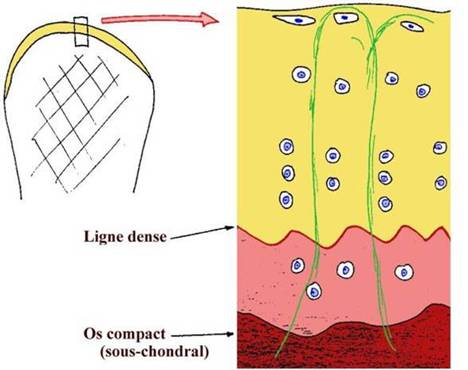
Les modifications morphologiques des cellules et de la matrice du cartilage articulaire identifient quatre couches histologiques de la surface à l’os sous chondral: une zone superficielle une zone transitionnelle une zone moyenne (ou radiaire ou profonde) et une zone calcifiée [Figure 1].
La zone superficielle très mince est faite de deux couches. Une surface articulaire acellulaire faite surtout de fines fibrilles. La couche superficielle proprement dite est surtout faite de fibrilles disposées parallèlement à la surface articulaire. Elle est aussi riche en fibronectine et en eau. Les chondrocytes y sont aplatis verticalement leur axe principal étant parallèle a la surface articulaire. 11s sont plus nombreux et métaboliquement moins actifs que ceux des autres zones. Cette structure permet une résistance aux forces de tension qui sont les plus importantes dans cette zone du cartilage. Elle gouverne aussi la perméabilité du cartilage faisant une barrière aux grosses molécules et aux anticorps. Son altération qui est la première lésion de l’arthrose (1) modifie la résistance du cartilage et permet la diffusion hors du tissu de molécules capables de générer une réponse inflammatoire ou immune.
La zone transitionnelle est plus riche en PG et contient des fibrilles plus épaisses et moins denses. Les cellules sont arrondies et riches en organelles de synthèse.
Dans la couche moyenne les chondrocytes arrondis tendent à s’aligner en colonnes perpendiculaires à la surface articulaire. Les fibrilles y sont plus épaisses la concentration en PG plus élevée et la teneur en eau plus faible.
La zone calcifiée qui représente 5 % de l’épaisseur totale est une couche de cartilage calcifié interposée entre la troisième zone et l’os sous chondral. Désignée « Tidemark » elle correspond histologiquement à l’interface entre le cartilage et l’os sous chondral où s’amarrent les fibres de collagène de la troisième zone profonde. Au cours du vieillissement un épaississement et un remodelage progressif résultent probablement de microtraumatismes répétitifs dans la zone profonde (zone 3). Ce processus involutif influence négativement les capacités du cartilage.
PROPRIéTéS BIOMéCANIQUES DU CARTILAGE
La propriété principale est la résistance à la pression maximale lorsque la disposition des fibres est parallèle à son axe. L’étude biomécanique démontre que lors d’une mise en charge ou d’une compression l’orientation des forces est parallèle à la surface du cartilage disposée en différentes directions dans sa partie moyenne et environ à 45° dans les régions les plus profondes du collagène exprimant une parfaite adaptation à l’exigence fonctionnelle. Comme indiqué la composition en PG et en eau varie en fonction des couches cartilagineuses.
La concentration en PG est la plus élevée dans les couches les plus profondes. Celle en eau la plus importante dans la zone transitionnelle décroît vers la profondeur. Les PG enrichissent le cartilage articulaire en eau lui conférant ainsi une meilleure résistance aux forces compressives.
L’eau outre son rôle biomécanique intervient également dans le transport des solutés contribuant ainsi à la lubrification articulaire.
Le cartilage est un matériel visco-élastique biphasique de par ses compositions solide et liquide. La réponse à la mise en charge ou à la compression et/ou au cisaillement combine la viscosité caractéristique des liquides et l’élasticité expressive des solides. Une caractéristique importante est la capacité à supporter la déformation et de revenir à la présentation initiale. Cette particularité est fondamentale dans la lubrification articulaire et la circulation liquidienne principalement en raison de la fonction de réponse aux mises en charge aux contraintes en l’absence de suppléance vasculaire et de système lymphatique. Une augmentation de la concentration en eau et une réduction de celle en PG diminue la rigidité du cartilage et élève la perméabilité de la matrice.
Le rôle principal du cartilage est la répartition et la transmission des contraintes principalement en compression sous l’effet de la charge il est le plus épais dans ces régions. Il intervient également dans l’absorption des chocs et dans le maintien de stress acceptables lors des contacts entre berges articulaires en particulier lors des mouvements de cisaillement.
|
|
| Figure 1: Cartilage articulaire |
ANATOMOPATHOLOGIE
La limite entre vieillissement (physiologique) du cartilage et cartilage arthrosique n’est pas clairement marquée. Cependant on peut schématiquement différencier trois stades:
Stade I : cartilage normal stade II : cartilage sénescent et stade III : cartilage arthrosique.
Le passage d’un cartilage normal (stade I) à un cartilage sénescent (stade II) plusieurs modifications structurales et biochimiques se produisent. La sénescence du cartilage touche les structures non collagèniques affaiblissant les propriétés biomécaniques du cartilage indispensable à la répartition des forces en zone portante. En effet les glycosaminoglycanes (GAG) sont modifiés qualitativement les GAG étant plus courts dans le cartilage sénescent. Ces modifications quantitatives et qualitatives des PG aboutissent à une moins bonne rétention des molécules d’eau. Ainsi le cartilage sénescent s’appauvrit en eau.
En plus les fissurations du cartilage observées lors du vieillissement sont essentiellement dues à des fractures de fatigue de la trame collagènique non renouvelée.
Articulation arthrosique (stade III)
L’articulation arthrosique se caractérise par des lésions à la fois cartilagineuses osseuses synoviales et capsulaires
Macroscopiquement le pincement articulaire l’apparition d’ostéophytes et la condensation de 1’os sous chondral en représentent les éléments les plus caractéristiques. L’hypothèse d’une réaction de 1’os sous chondral aux anomalies biomécaniques du cartilage arthrosique qui le surplombe reste d’actualité. L’os sous chondral réagirait ainsi aux pressions anormales habituellement amorties par un cartilage normal.
Cependant cette hypothèse parait moins plausible si l’on s’intéresse aux articulations non portantes telles que l’arthrose digitale au tours de laquelle l’ostéophytose est au premier plan.
Histologiquement plusieurs phases ont été définies:
- Phase 1 : perte de l’aspect lisse et apparition de microfissures ;
- Phase 2 : fissuration. Les microfissures s’approfondissent perpendiculairement à la direction des forces de cisaillement tangentielles et le long des fibrilles collagènes. Des ilots de chondrocytes apparaissent en périphérie de ces lésions ainsi qu’en surface ;
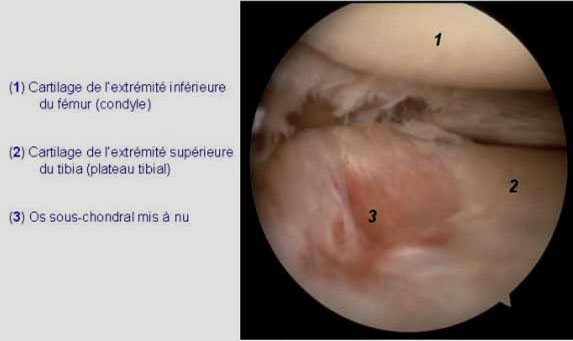
- Phase 3 : érosion. L’importance des fissurations aboutit au détachement de lambeaux de cartilage qui (tombent) dans la cavité articulaire mettant à nu 1’os sous chondral [Figure 2]. Une inflammation synoviale peut alors être observée.
L’atteinte osseuse se manifeste par une ostéosclérose sous chondrale par apposition de nouvelles lamelles osseuses. En périphérie de cette zone se forment des ostéophytes dont la surface est recouverte de cartilage fibrillaire (2).
|
|
|
Figure 2: Image arthroscopique du genou arthrosique |
PATHOGENlE DE L’ARTHROSE
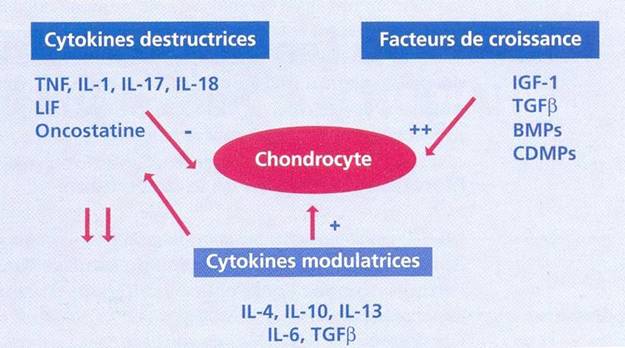
Le métabolisme du cartilage est soumis en permanence à un équilibre critique entre les mécanismes de dégradation sous l’influence de cytokines destructrices et les mécanismes de synthèse ou de restauration sous l’effet de cytokines modulatrices et des facteurs de croissance [Figure 3]. L’arthrose survient habituellement dans des conditions de surcharge excessive d’une matrice cartilagineuse normale ou de surcharge normale d’une matrice cartilagineuse vulnérable.
Il est maintenant admis que la destruction arthrosique du cartilage est le résultat d’un déséquilibre entre anabolisme et catabolisme de la matrice extracellulaire (3).
Le déséquilibre est provoqué par :
- une synthèse accrue de protéases (et plus particulièrement de certaines métalloprotéases) qui ont pour substrat les protéines collagèniques et non collagèniques de la matrice (4) ; une diminution de la synthèse d’inhibiteurs naturels des protéases (les TIMP) ;
- une inhibition de synthèse de la matrice fonctionnelle par le chondrocyte arthrosique ;
Ce déséquilibre est accentué par une apoptose chondrocytaire accélérée (5) et par une activation chondrocytaire par le tissu synovial.
Les chondrocytes une fois activés deviennent aptes à synthétiser différentes protéases mais également différents médiateurs proinflammatoires (6).
|
|
|
Figure 3: les différents facteurs agissant sur le cartilage |
Mécanismes de dégradation du cartilage
Plusieurs protéases sont à l’origine de la destruction du cartilage observée au tour du processus arthrosique.
Les métalloprotéases (MMP) constituent qualitativement la famille prédominante car elles sont activées à pH neutre c’est-à-dire activent directement dans les milieux extracellulaires et en particulier dans la matrice cartilagineuse. I1 existe une douzaine de MMP différentes dont certaines restent liées aux membranes cellulaires (MT-MMP) (7). Elles sont synthétisées par les chondrocytes et les synoviocytes sous I’effet de cytokines.
L’aggrecanase enzyme qui clive la liaison Glu373- Ala374 du domaine interglobulaire de l’aggrecane joue également un rôle majeur dans la dégradation de la matrice. Elles appartiennent a la famille des métalloprotéases et plus spécifiquement des ADAMTS (disintegrin and metalloproteinase with tbrombospondin) (8 9).
D’autres enzymes ayant pour substrat le collagène de type II et les protéoglycanes sont synthétisées par le chondrocyte. Elles ne sont actives qu’a pH acide telles que les aspartate protéases (cathepsine D) et les cysteines protéases (cathepsines B H K L et S) stockées dans les lysosomes chondrocytaires puis libérées dans le microenvironnement pericellulaire.
En dehors des protéases il ne faut pas oublier l’importance théorique des enzymes capables de dégrader les chaînes glucidiques présentes en grande quantité dans les PG. Ces glycosidases n’ont pas encore fait l’objet de travaux spécifiques dans l’arthrose mais elles jouent certainement un rôle important dans la dégradation de la matrice.
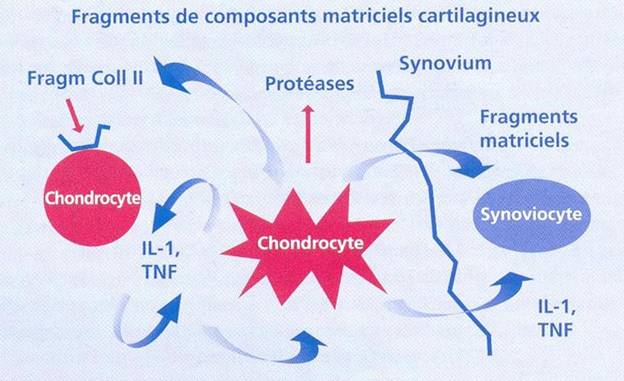
Les cytokines pro-inflammatoires et en particulier 1’IL-1 et le TNF-a synthétisés par les chondrocytes et les synoviocytes activent ces mêmes cellules par leur liaison à des récepteurs spécifiques par l’intermédiaire de voies de signalisation spécifiques aux cytokines [Figure 4].
L’IL-1 apparaît comme la cytokine la plus impliquée dans les processus de dégradation du cartilage dans l’arthrose comme l’on confirmé différents travaux expérimentaux:
La suppression des lésions du cartilage dans l’arthrose expérimentale grâce à la thérapie génique par l’IL-1ra (antagoniste des récepteurs de l’IL-1) ;
L’augmentation des lésions du cartilage dans l’arthrose induite chez des souris déficientes en IL-1b ;
La diminution des lésions du cartilage chez des souris déficientes en IL-1b uniquement dans l’arthrose induite légère et instable.
L’IL-1 provoque une diminution d’expression des collagènes de type II et IX tout en augmentant la synthèse des collagènes de type I et III (10).
D’autres cytokines destructrices peuvent intervenir sur le cartilage tel l’IL-17 ou l’IL-18…
Le monoxyde d’azote (NO) est un gaz synthétisé via l’oxydation de la L-arginine par une famille d’enzymes les NO synthétases. Le NO a forte concentration pourrait intervenir également dans la dégradation de la matrice apparaissant comme un relais de signalisation à l’action de l’IL- 1 cytokine impliquée dans la diminution de production de protéoglycanes l’augmentation de la synthèse des metalloprotéases et l’induction de I’apoptose chondrocytaire (11 12).
En dehors des cytokines certains dérivés lipidiques sont capables de participer à cette activation cellulaire (13). Par exemple les prostaglandines produites après activation de phospholipases A2 et cyclo-oxygenases peuvent favoriser la synthèse de protéases en activant la cellule par l’intermédiaire de récepteurs cellulaires ou nucléaires spécifiques des prostaglandines. Là encore certaines voies de signalisation spécifiques sont mises en jeu aboutissant à l’induction de la transcription de gènes de certaines protéases. Enfin des produits de dégradation de la matrice elle même sont capables d’activer les chondrocytes par l’intermédiaire de récepteurs de type integrine pour synthétiser des métalloprotéases et des cytokines. C’est le cas par exemple de certains fragments de la fibronectine. (14).
I1 est maintenant démontré au moins in vitro que le tissu synovial est capable de produire de nombreux médiateurs impliqués dans la destruction (cytokines protéases) qui libéré dans la cavité articulaire viennent aggraver les phénomènes de destruction enclenchés par le chondrocyte (15).
Enfin 1’os sous chondral pourrait participer aux phénomènes dégradatifs de la matrice observée au tous de l’arthrose probablement par le biais d’une sécrétion d’enzymes protéolytiques par les cellules osseuses (16).
|
|
|
Figure 4: les processus intervenant dans une articulation arthrosique |
La tentative de réparation du cartilage
De nombreux travaux s’orientent actuellement vers la responsabilité de l’os sous-chondral dans cette tentative de réparation (17). En effet au tour du processus arthrosique on observe un métabolisme accéléré de 1’os sous chondral bien visible par exemple en scintigraphie osseuse au Tc99m (16).
Selon Lajeunesse (18) l’os sous chondral subirait des transformations précoces (ostéosclérose ostéophytes) en réponse à la surcharge mécanique ou aux microfractures. L’os rigidifié par la sclérose perdrait ses propriétés élastiques et induirait une fragilisation du cartilage.
L’activation chondrocytaire initiale serait à l’origine d’une tentative de réparation par la synthèse précoce de facteur de croissance notamment le TGF B et l’IGF1. Les ostéoblastes et les chondrocytes expriment le TGF B qui est à l’origine d’un anabolisme de synthèse de la matrice d’une inhibition des cytokines proinflammatoires d’une action mitogène pour les chondrocytes et provoque la formation d’ostéophytes.
Pour Lajeunesse la dérégulation du système plasminogène/ plasmine induite par l’IGF1 induirait aussi la sécrétion de protéases dans le cartilage favorisant parallèlement la dégradation cartilagineuse.
Selon Moskowitz (19) le remodelage osseux ne jouerait un rôle dans l’évolution de l’arthrose qu’une fois qu’elle a débuté : l’altération des propriétés biomécaniques de l’os aggraverait l’arthrose en majorant les contraintes articulaires.
Récemment il a été démontré que les ostéoclastes des patients arthrosiques relarguent du NAG (N-acétyl-b-D-glucosaminidases) une enzyme de dégradation de la matrice cartilagineuse en réponse à la l’IL8 (20).
L’effet protecteur ou délétère des ostéophytes sur le cartilage est discuté : pour certains la présence d’ostéophytes serait prédictive d’une stabilité de l’arthrose reflétant un processus de réparation réussi (19). Les ostéophytes permettraient une redistribution des pressions articulaire protégeant le cartilage. Pour d’autres la présence de gros ostéophytes serait corrélée à la gravité des lésions cartilagineuses sur le même site.
Certaines cytokines possèdent des propriétés antidégradatives. C’est le cas de l’interleukin-l-receptorantagonist (IL-IRA) (21) l’IL-4 I’IL-6 I’IL-10 et l’IL-13 qui empêchent la sécrétion de certaines métalloprotéases et augmentent dans certaines conditions la synthèse des TIMIP de façon plus générale I’IL-4 et l’IL-13 s’opposent aux effets cataboliques de I’IL- 1.
INITIATION DU PROCESSUS ARTHROSIQUE
L’initiation du processus arthrosique reste encore très mal comprise. L’activation chondrocytaire implique des facteurs locaux généraux génétiques et environnementaux. 11 est certain que le poids de chacun de ces facteurs dépend de la localisation de l’articulation (articulation portante ou non portante) et pour une même articulation du compartiment touché (zone superficielle ou profonde zone portante ou non portante).
L’origine mécanique
L’arthrose sur articulation portante se développe plus fréquemment en cas d’obésité (gonarthrose et coxarthrose) ou en cas de microtraumatismes répétés (arthrose du coude provoquée par le marteau-piqueur coxarthrose du sportif gonarthrose du carreleur...) aboutissant à une hyperpression articulaire. De même un vice architectural sur articulation portante peut aboutir à des pressions réparties anormalement sur le cartilage et aboutir à une arthrose précoce (dysplasie de hanche genu valgum ou genu varum...). I1 est donc logique d’incriminer en premier lieu cet élément mécanique qui et lui seul devrait suffire à entraîner une arthrose. Cependant cette seule explication ne suffit pas puisque l’incidence de la maladie dans les populations à risque n’est pas de 100 %. Une autre hypothèse a l’initiation du processus
arthrosique invoque des modifications structurales de 1’os sous chondral. Pour certains auteurs l’os sous chondral est l’initiateur de l’arthrose. L’induction de pressions répétées induisait une réponse osseuse précoce avec augmentation de la formation osseuse et épaississement de l’os sous chondral suivie par la dégénérescence du cartilage.
L’origine génétique
La fréquence des formes familiales de certaines arthroses telles que l’arthrose digitale implique intuitivement l’existence d’un ou plusieurs facteurs génétiques. De plus des études comparatives entre jumeaux ont montre récemment que la génétique intervenait également dam l’arthrose primitive de hanche (22).
II faut avouer qu’a l’heure actuelle aucune anomalie génétique importante n’a pu être mise en évidence chez les patients atteints d’arthrose commune (23).
L’origine hormonale
L’arthrose est plus fréquente chez la femme après 50 ans. Cette fréquence diminue lorsque ces femmes prennent un traitement substitutif oestroprogestatif. Les chondrocytes possèdent des récepteurs aux oestrogènes (24). Leur stimulation provoque la synthèse de facteurs de croissance. Apres la ménopause la concentration plasmatique en estrogènes diminue ce qui pourrait a priori provoquer une diminution de synthèse de facteurs de croissance par les chondrocytes. Il est donc tentant d’imaginer un ou plusieurs facteurs hormonaux impliques dans l’initiation de l’arthrose.
Conclusion
La meilleur compréhension de la physiopathologie de l’arthrose et la progression des connaissances de ces dernières années grâce aux progrès de la biologie moléculaire fait que la maladie est en plein essor et que de nouvelles cibles thérapeutiques spécifiques à cette maladie sont définit notamment le TNF l’IL6 et la greffe du cartilage.
1. Glaser C. and Puts R. Functional anatomy of articular cartilage The specific role of the tangential layer with regard to the development of OA. ESSR 4th annual meeting Venice october 1997; 10-11.
2. Setton LA Elliott DM Mow VC. Altered mechanics of cartilage with osteoarthritis: human osteoarthritis and an experimental model of joint degeneration. Osteoarthritis Cartilage 1999; 7: 2-14.
3. Hamerman D. The biology of osteoarthritis. N Engl J Med 1989; 320: 1322-30.
4 Blanc0 Garcia FJ. Catabolic events in osteoarthritic cartilage. Osteoarthritis Cartilage 1999; 7: 308-9.
5. Hashimoto S Ochs RL Komiya S Lotz M. Linkage of chondrocyte apoptosis and cartilage degradation in human osteoarthritis. Arthritis Rheum 1998; 41: 1632-8.
6. Vignon E Balblanc JC Mathieu P Louisot P Richard M. Metalloprotease activity phospholipase A2 activity and cytokine concentration in osteoarthritis synovial fluids. Osteoarthritis Cartilage 1993; 1: 115-20.
7. Cawston T. Matrix metalloproteinases and TIMPs: properties and implications for the rheumatic diseases. Mol Med Today 1998; 4: 130-7.
8. Abbaszade I Liu RQ Yang F Rosenfeld SA Ross OH Link JR et al. Cloning and characterization of ADAMTS 11 anaggrecanase from the ADAMTS family. J Biol Chem 1999; 274: 243-50.
9. Tortorella MD Burn TC Pratta MA Abbaszade I Hollis JM Liu R et al. Purification and cloning of aggrecanase-1: a member of the ADAMTS family of proteins. Science 1999; 284:1664-6.
10. Goldring MB Birkhead J Sandell LJ Kimura T Krane SM. Interleukin 1 suppresses expression of cartilage-specific types II and IX collagens and increases types I and III collagens in human chondrocytes. J Clin Invest 1988; 82: 2026-37.
11. Taskiran D Stefanovic-Racic M Georgescu H Evans C. Nitric oxide mediates suppression of cartilage proteoglycan synthesis by interleukin-1. Biochem Biophys Res Commun 1994; 200: 142-8.
12. Lotz M. The role of nitric oxide in articular cartilage damage. Rheum Dis Clin North Am 1999; 25: 269-82.
13. Jacques C Bereziat G Humbert L Corvol M Olivier JL Masliah J et al. Post-transcriptional effect of IGF-I on IL-1 beta-induced type II secreted phospholipase A2 gene expression in rabbit articular chondrocytes. J Clin Invest 1997; 99: 1864-72.
14. Chevalier X. Fibronectin osteoarthritis and cartilage. Semin Arthritis Rheum 1993; 22: 307-18.
15. Smith MD Triantafillou S Parker A Youssef PP Coleman M. Synovial membrane inflammation and cytokine production in patients with early osteoarthritis. J Rheumatol 1997; 24: 365-71.
16. Westacott CI Webb GR Warnock MG Sims JV Elson CJ. Alteration of cartilage metabolism by cells from osteoarthritic bone. Arthritis Rheum 1997; 40: 1282-91.
17. Hilal G Martel-Pelletier J Pelletier JR Ranger p Lajeunesse D Osteoblast-like cells from human subchondral bone demonstrate an altered phenotype in vitro: possible role in subchondral bone sclerosis. Arthritis Rheum 1998; 41: 981-99.
18. Lajeunesse D Hilal G Pelletier JP Pelletier JM. Subchondral bone morphological and biochimical alterations in osteorthritis. Osteoarthritis cartil 1999; 7: 321 – 2.
19. Moskowitz RW. Bone remodiling in osteoarthritis: Subchondral and osteophytic reponses. Osteoarthritis cartil 1999; 7: 323-4.
20. Lisignoli C Tonegozzi S Piacentini A Grassi F Lenti A Tchon M et al. Osteoblasts from osteoarthritis patients express fonctional receptors for IL8. Arthritis Rheum 2001; 44: S45.
21. Caron JP Fernandes JC Martel-Pelletier J Tardif G Mineau F Geng C et al. Chondroprotective effect of intraarticular injections of interleukin-1 receptor antagonist in experimental osteoarthritis. Suppression of collagenase-1 expression. Arthritis Rheum 1996; 39: 1535-44.
22. MacGregor AJ Antoniades L Matson M Spector TD. The genetic contribution to radiographic hip osteoarthritis: a population- based twin study. Arthritis Rheum 1998; 41: S358.
23. Loughlin J Irven C Fergusson C Sykes B. Sibling pair analysis shows no linkage of generalized osteoarthritis to the loci encoding type II collagen cartilage link protein or cartilage matrix protein. Br J Rheumatol 1994; 33: 1103-6.
24. Blanchard 0 Tsagris L Rappaport R Duval-Beaupere G Corvol M. Age-dependent responsiveness of rabbit and human cartilage cells to sex steroids in vitro. J Steroid Biochem Mol Biol 1991; 4: 711-6.
Articles les plus lus
- L'arthrose cervicale
- L'arthrose lombaire
- La spondylarthrite ankylosante
- La fibromyalgie
- Coxarthrose
- Les anti-inflammatoires non stéroïdiens. Modalités de prescription.
- Apport de l’échographie dans le diagnostic d’une épaule douloureuse.
- La gonarthrose
- La maladie de Behçet
- Diagnostic précoce de la polyarthrite rhumatoïde